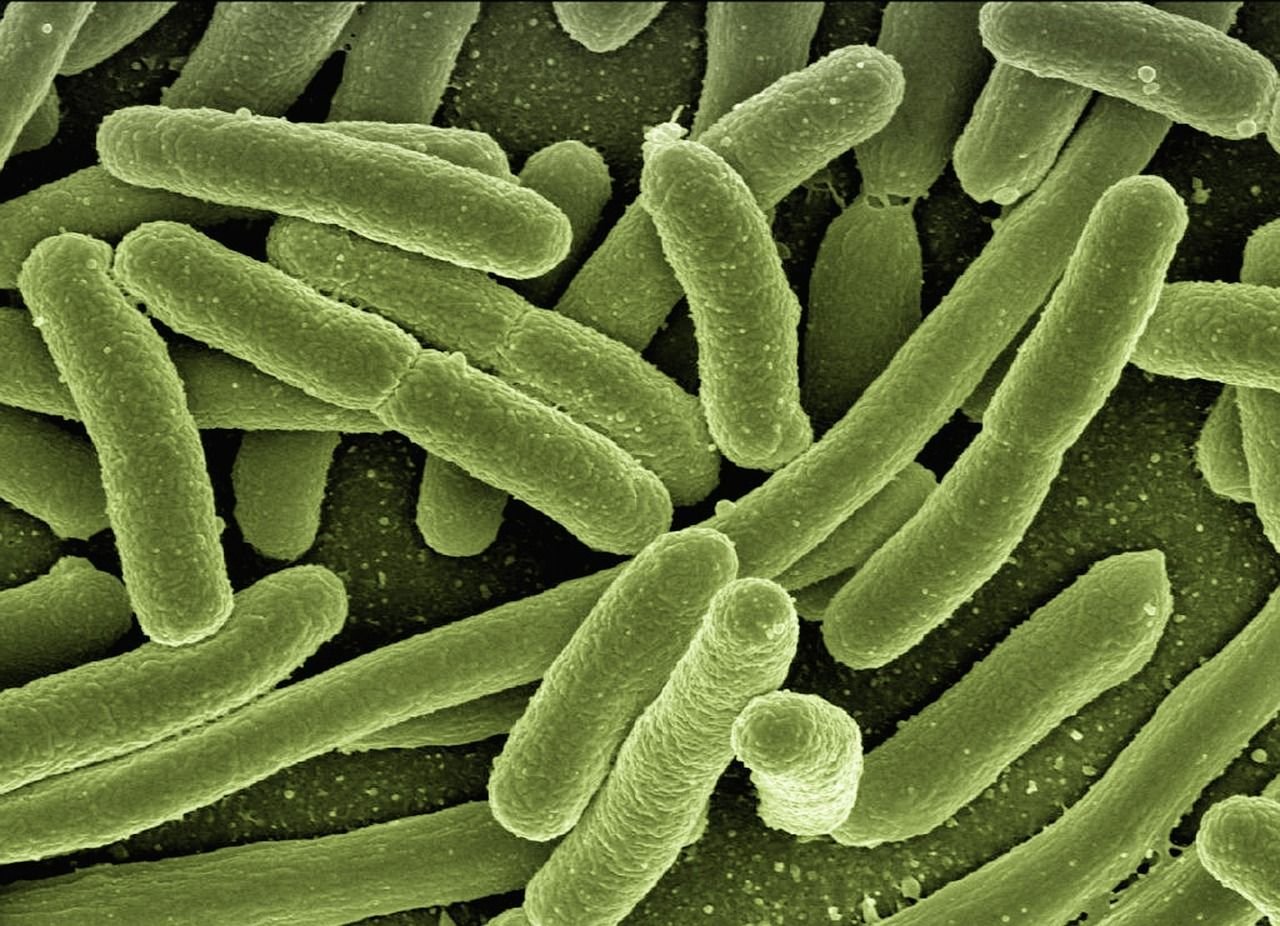
Matematika v boji proti bakteriálním onemocněním
Vědci z Univerzity Karlovy vyvinuli matematický model, který vysvětluje mechanizmy růstu a remodelace buněčné stěny bakterií během dělení, přičemž klíčovou roli hraje napětí v peptidoglykanové struktuře ovlivněné elastickými deformacemi. Tento model umožňuje klasifikovat různé mutace ovlivňující enzymy podílející se na obnově stěnových sítí a pomáhá lépe porozumět jejich vlivu na morfologii bakterií, což může výrazně usnadnit vývoj nových antibiotik. Vědci plánují model rozšířit i na další typy bakterií a rostlin.
Klíčovým cílem v antimikrobiální terapii je syntéza a remodelace buněčné stěny bakterií. Jde o tuhý obal, který odděluje bakteriální buňku od jejího okolí, a skládá se ze síťovaného polymeru, známého také jako peptidoglykan nebo murein.
Bakteriální buňky se množí dělením. Během tohoto procesu prochází peptidoglykanová stěna složitou transformací, v rámci které dojde nejprve k zúžení a poté k oddělení vznikající bakterie. Jedním z klíčových momentů tohoto procesu je přitom růst tzv. septa, které funguje jako stěna během procesu dělení.
V předchozí studii se části výzkumného týmu podařilo shromáždit data o lokální struktuře místa, kde dochází k dělení tzv. divokého typu ( ) bakterie a zmutovaných variant. Výzkumníci zjistili, že tyto mutace vykazují nedostatek či naopak nadbytek některých složek aparátu bakteriálního dělení, což následně vede k odlišné dynamice dělení a celkově k odlišné morfologii bakterií během a po procesu dělení.
V nové studii, publikované v prestižním časopise PNAS, se vědci z Univerzity Karlovy zaměřili na to, jak toto množství dat vysvětlit pomocí elegantního matematického modelu. Jeho základem byla hypotéza, že jak růstové, tak restrukturalizační procesy jsou řízeny napětím uvnitř bakteriální stěny. Toto napětí zase pochází z elastických deformací, které jsou odpovědí na tlak uvnitř bakteriální buňky.
Způsob, jak bakteriální růst a remodelace reagují na stres, je podle autorů tím, co od sebe odlišuje jednotlivé mutace. Mohou například postrádat jeden z enzymů zodpovědných za opětovné síťování, a to sníží odezvu na tu část stresu, která je zodpovědná za řízení fluidity.
Tímto jednoduchým přístupem, který se spoléhá pouze na dva parametry, je možné klasifikovat celé spektrum známých defektů a kombinací zmutovaných variant bakterie . To zase následně ověřuje model růstu. Vědci tedy nyní mohou interpretovat a klasifikovat například vliv cílené inhibice jednoho nebo několika růstových enzymů na bakteriální stěnu, což by do budoucna mělo usnadnit vývoj nových antibiotik.
říká dr. Christoph Allolio, spoluautor studie a vedoucí výzkumné skupiny, která se na Matematickém ústavu UK zabývá remodelací biomembrán.
Upravený model teď chtějí vědci využít i při studiu dalších typů bakterií a také rostlin. doplňuje dr. Allolio.
https://www.mff.cuni.cz/cs/verejnost/aktuality/matematika-v-boji-proti-bakterialnim-onemocnenim